11月29日,卫材公司在于旧金山召开的CATD大会上宣布了阿尔茨海默病(AD)新药,抗β淀粉样蛋白(Aβ)抗体药物Lecanemab的3期临床研究Clarity AD的临床研究成果。
在Aducanumab争议不断、Gantenerumab宣告失败的当下,Lecanemab是否能够取得正面的结果,是关注AD新药研发、尤其是Aβ这一争议靶点的学者和大众都颇为在意的问题。
令人高兴的是,Clarity AD试验的结果无疑是充满希望的。Lecanemab治疗18个月,治疗组相对安慰剂组临床痴呆评分总和量表(CDR-SB)评分下降减缓了27%,其他次要终点指标均有改善。论文同步发表在《新英格兰医学杂志》(NEJM)上[1]。
Clarity AD是一项为期18个月的多中心双盲3期临床试验,纳入了1795名早期AD患者,即经正电子断层发射断层扫描(PET)或脑脊液证据确诊的AD相关轻度认知障碍或轻度痴呆患者。参与者随机分配至治疗组和安慰剂组,接受10mg/kg/双周静脉注射治疗,主要终点为CDR-SB评分较基线变化,次要终点为PET检测的淀粉样蛋白负荷变化和ADAS-cog14、ADCOMS、ADCS-MCI-ADL量表评分变化。
两组患者基线CDR-SB评分均为3.2,符合早期AD标准范围(0.5-6)。18个月时,治疗组CDR-SB评分为1.21,安慰剂组为1.66,绝对差值-0.45,评分下降延缓了27%。其他三项认知/行为评估结果也显示,Lecanemab带来了显著的改善。
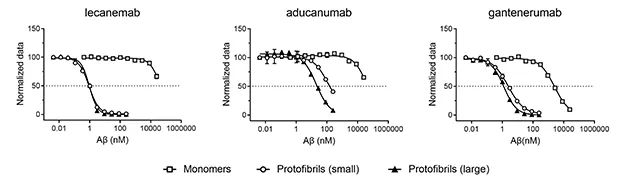
有698名患者接受了PET检查,18个月时治疗组脑内淀粉样蛋白负担变化为-55.48 centiloids,安慰剂组则为3.64 centiloids,可见Lecanemab有效地清除了患者脑内的蛋白斑块。

而对脑脊液和血浆生物标志物的分析则显示,除脑脊液NfL外,治疗组所有指标均有改善。研究者认为,脑脊液NfL对神经退行性疾病并不敏感,可能需要更长时间才能观察到数值的变化。
Lecanemab的安全性相对较好。治疗组中26.4%的患者出现了输液相关反应,12.6%出现了ARIA-E。ARIA-E中91%为轻度至中度,78%无症状,71%发生在治疗的前三个月,81%在发生4个月内消退。Lecanemab治疗发生ARIA-E的比例仅有此前获批的Aducanumab的三分之一左右,可以说Lecanemab的安全性是值得肯定的。
问题在于,18个月的治疗周期,对于AD来说显然是并不够长的,后续的数据将在Clarity AD的开放标签研究中继续公布。
此外值得关注的是,认知量表数值的变化与临床上有意义的认知改善之间到底是怎样的关系,目前还有争议。此前一项研究系统估算了认知量表分值与临床意义之间的关系,结果显示最小临床意义差异随疾病严重程度增加,对于MCI和轻度AD来说,CDR-SB最小差异为0.98和1.63[3]。
一直以来,AD新药困难重重,尤其是走得最远也跌倒得最多的Aβ类药物,始终未能以有力的姿态改变局面。但时至今日,AD理论已经向多个方向发展,Aβ早已不再是唯一的选择,相信在不远的将来,我们可以揭开AD的神秘面纱,拿到攻克AD的关键武器。
参考资料:
[1]https://www.nejm.org/doi/pdf/10.1056/NEJMoa2212948
[2]https://www.alzforum.org/news/conference-coverage/lecanemab-sweeps-toxic-av-protofibrils-catches-eyes-trialists
[3] Andrews JS, Desai U, Kirson NY, Zichlin ML, Ball DE, Matthews BR. Disease severity and minimal clinically important differences in clinical outcome assessments for Alzheimer’s disease clinical trials. Alzheimers Dement 2019; 5: 354–63.
文章来源:奇点网



评论 (0)