找到
35
篇与
AD
相关的结果
-
 吃得越少,活得越久,脑子越好”的原因找到了!Nature子刊:限制饮食能延寿和护脑,背后关键环节在于... 饮食/热量限制(Dietary/Caloric Restriction)能延缓衰老并非新闻。自古以来,人们便意识到了限制饮食或热量的重要性。《黄帝内经》中有这样一句养生之道:食饮有节,起居有常,不妄作劳,故能形与神俱,而尽终其天年,度百岁乃去。东晋时期著名医生葛洪曾言,不欲极饥而食,食不过饱。现在人们最常提到的“饭吃八分饱”的说法,也与其有着异曲同工之处。饮食/热量限制(DR/CR),是指在满足必需营养素(如必需氨基酸、维生素、必需脂肪酸等)摄取的情况下,减少能量摄入。从现代科学来看,饮食限制能延寿并非“空穴来风”,目前已在多物种中观察到其抗衰老、延寿命的作用,包括酵母、啮齿动物、非人类灵长动物,甚至人类身上。在现实生活中,衰老往往伴随着“认知能力下降”现象的发生。于是,研究者开始思考,既然饮食限制能够延缓物种的衰老,是否也同样能起到保护大脑的作用呢?最近,来自美国巴克衰老研究所的研究团队回答了上述问题,并从细胞学机制层面找到了饮食限制能延长寿命和保护大脑的关键一环——mtd/OXR1基因。具体来说,在饮食限制的条件下,mtd/OXR1可以维持逆转录酶,从而保护神经健康和延缓大脑衰老。该研究发表在Nature Communications上。研究者早已观察到,人耐氧化性能蛋白(OXR1)基因具有着重要作用——如果基因发生变异,会导致小脑萎缩、张力减退、语言发育迟缓和癫痫发作等一系列疾病。相反,在肌萎缩侧索硬化症(ALS)的小鼠模型中,OXR1基因的过表达则能够提高存活率。那么,在神经缺陷和过早死亡的发生过程中,OXR1基因是否发挥了保护作用?又是如何发挥的呢?为了回答这一问题,研究者扫首先描了160种具有不同遗传背景的果蝇,并在自由进食(AL)和DR(约正常饮食的10%)的条件下进行喂养。在测试了果蝇寿命后,定位到了5个与“DR诱导的长寿”显著相关的基因,它们均具有特定的遗传变异。但在上述5个基因中,仅仅铁氧还原蛋白(Fdxh)和mustard(mtd)有人类同源基因,分别对应着铁氧还原蛋白2和OXR1。对比发现,由Act5c-GS-Gal4驱动的全身mtdRNA干扰会导致DR特异性的寿命缩短,而FdxhRNA干扰则无法诱导该现象。也就是说,mtd表达在DR介导的长寿过程中发挥着重要作用。于是,在这两个基因中,研究者选择了与人类和小鼠OXR1相对应的基因mtd,而后续研究将基于mtd深入展开。有意思的是,研究者在果蝇的头部观察到,DR条件下的mtd mRNA表达量增加了7倍。如果能一直坚持DR,整个生命周期中的mtd表达均显著增加。也就是说,饮食限制能够增加果蝇神经元中mtd的表达。但与之相反,当采用组成型活性elav-Gal4驱动神经元mtd mRNA干扰后,无论是采用何种饮食模式,甚至DR,均会诱导果蝇发育缺陷的发生以及严重的寿命缩短。Mtd/OXR1中的TLDc结构域发挥着保护神经的作用。于是,研究者进一步在不携带mtd等位基因的果蝇神经元中过表达了缩减的人OXR1基因(hOXR1OE),观察到果蝇“找回了”丢失的寿命和DR反应。由此可见,神经元mtd的表达是DR介导的寿命延长过程中必不可少的一环,如果将其敲除则会诱发严重的发育缺陷以及寿命缩短。利用公开的ChIP-seq数据,研究者找到了DR中调节mtd表达的关键点——Traffic Jam(TJ)。具体来说,ChIP-seq数据显示基因座上存在CCCTC结合因子(CTCF)和TJ的重要结合信号。其中,诱导性神经元ctcfRNA干扰增加了mtd的表达,而tjRNA干扰则导致DR条件下所有mtd转录表达的降低以及寿命的缩短。事实上,饮食限制主要限制了整体蛋白质摄入量,进一步的验证显示,蛋白质限制诱导的mtd增加受到TJ的调控,从而延长了果蝇的寿命;但在正常饮食条件下,mtd表达则会受到CTCF的影响而被抑制。不过,这些效应只影响变异位点和TJ/CTCF结合位点下游的较短转录本。研究者解释道,体内营养相关成分的增加并非好事儿,反而可能会带来一定的健康损害,比如逆转录酶失调,甚至进一步缩短了寿命。在“向下”找到了影响mtd表达的关键因素之后,接下来“向上”探索mtd影响寿命的具体机制。这个过程究竟是如何实现的呢?研究者分析了与人OXR1共表达模式相似的前50个基因的基因本体(GO)术语,并对人成纤维细胞的OXR1和囊泡转运细胞器标记物进行了共同染色,包括溶酶体、核内体、高尔基体、内质网和线粒体。进一步的实验观察到,OXR1染色与内体标志物RAB7高度重叠。这时候,如果对神经元mtdRNA进行干扰,会发现果蝇体内Atg8a-II水平有所增加,即自噬体形成的标志物增加。研究者解释道,由于内吞蛋白和脂质的不当运输,内体中逆运复合体(retromer)功能障碍会导致溶酶体功能障碍,以及自噬体形成的增加。因此,可以推测,OXR1具有维持逆运复合体功能的作用。果不其然,当研究者对果蝇体内的神经元mtdRNA和tjRNA进行干扰时,逆运复合体蛋白水平被显著降低了,证明上述推测是正确的。事实上,对于健康的神经元来说,逆运复合体的维持是必不可少的;相反,当缺失逆运复合体蛋白时,则会诱导神经退行性疾病的发生。所以,mtd基因之所以能发挥抗衰和保护神经的作用,是因为它参与了逆运复合体功能的维持。最后一步,回归人体——mtd/OXR1表达是否能够发挥防止神经退行性疾病和阿尔茨海默症发生的作用呢?利用人类组学数据集,研究者观察到,在丰度水平与OXR1基因呈正相关的蛋白质和受年龄影响的基因中,有83个基因存在重叠。进一步对数据集重叠基因进行KEGG通路分析,结果显示,与年龄相关的神经退行性疾病(包括阿尔茨海默症、亨廷顿氏症、帕金森病等)均出现了显著的富集。此外,研究者观察到,低水平的OXR1、VPS35、SNX5和RAB7A与阿尔茨海默症的诊断、记忆力和病理评分低下有关,而这些都是人OXR1和逆运复合体相关蛋白。相反,如果过表达了OXR1或逆运复合体,则能够挽救与阿尔茨海默症以及tau病理相关的表型。正如先前提到的那样,逆运复合体功能障碍与年龄相关性退行性神经疾病(比如阿尔茨海默症)之间有着紧密联系,尤其是在疾病进展的转运和突触功能的维持。鉴于OXR1与逆运复合体之间的关系,OXR1及其蛋白网络是减缓人类和果蝇衰老和与年龄相关的神经退行性疾病的关键调节剂。综上所述,本研究发现了一个重要基因mtd/OXR1——在间歇性禁食或者卡路里限制等营养限制的策略中,mtd/OXR1基因水平会有所提高,进一步激活了逆运复合体功能,发挥出维持神经元功能、延缓大脑衰老以及寿命延长等多种作用,对大脑健康产生正向影响。本研究的共同通讯作者Kenneth Wilson还强调了另一个观点“饮食会影响人体内所有的过程”。所以,只要你努力坚持健康饮食方式,身体是不会“辜负”你的,而且这种影响会比你想象得更大。总结来说,吃得少,活得久,脑更灵。春节想必大家一定吃了不少吧,从今天开始可以加入“少吃”行列了哦参考资料:[1]Wilson, K.A., Bar, S., Dammer, E.B. et al. OXR1 maintains the retromer to delay brain aging under dietary restriction. Nat Commun 15, 467 (2024). https://doi.org/10.1038/s41467-023-44343-3撰文 | Swagpp编辑 | Swagpp文章来源:梅斯医学
吃得越少,活得越久,脑子越好”的原因找到了!Nature子刊:限制饮食能延寿和护脑,背后关键环节在于... 饮食/热量限制(Dietary/Caloric Restriction)能延缓衰老并非新闻。自古以来,人们便意识到了限制饮食或热量的重要性。《黄帝内经》中有这样一句养生之道:食饮有节,起居有常,不妄作劳,故能形与神俱,而尽终其天年,度百岁乃去。东晋时期著名医生葛洪曾言,不欲极饥而食,食不过饱。现在人们最常提到的“饭吃八分饱”的说法,也与其有着异曲同工之处。饮食/热量限制(DR/CR),是指在满足必需营养素(如必需氨基酸、维生素、必需脂肪酸等)摄取的情况下,减少能量摄入。从现代科学来看,饮食限制能延寿并非“空穴来风”,目前已在多物种中观察到其抗衰老、延寿命的作用,包括酵母、啮齿动物、非人类灵长动物,甚至人类身上。在现实生活中,衰老往往伴随着“认知能力下降”现象的发生。于是,研究者开始思考,既然饮食限制能够延缓物种的衰老,是否也同样能起到保护大脑的作用呢?最近,来自美国巴克衰老研究所的研究团队回答了上述问题,并从细胞学机制层面找到了饮食限制能延长寿命和保护大脑的关键一环——mtd/OXR1基因。具体来说,在饮食限制的条件下,mtd/OXR1可以维持逆转录酶,从而保护神经健康和延缓大脑衰老。该研究发表在Nature Communications上。研究者早已观察到,人耐氧化性能蛋白(OXR1)基因具有着重要作用——如果基因发生变异,会导致小脑萎缩、张力减退、语言发育迟缓和癫痫发作等一系列疾病。相反,在肌萎缩侧索硬化症(ALS)的小鼠模型中,OXR1基因的过表达则能够提高存活率。那么,在神经缺陷和过早死亡的发生过程中,OXR1基因是否发挥了保护作用?又是如何发挥的呢?为了回答这一问题,研究者扫首先描了160种具有不同遗传背景的果蝇,并在自由进食(AL)和DR(约正常饮食的10%)的条件下进行喂养。在测试了果蝇寿命后,定位到了5个与“DR诱导的长寿”显著相关的基因,它们均具有特定的遗传变异。但在上述5个基因中,仅仅铁氧还原蛋白(Fdxh)和mustard(mtd)有人类同源基因,分别对应着铁氧还原蛋白2和OXR1。对比发现,由Act5c-GS-Gal4驱动的全身mtdRNA干扰会导致DR特异性的寿命缩短,而FdxhRNA干扰则无法诱导该现象。也就是说,mtd表达在DR介导的长寿过程中发挥着重要作用。于是,在这两个基因中,研究者选择了与人类和小鼠OXR1相对应的基因mtd,而后续研究将基于mtd深入展开。有意思的是,研究者在果蝇的头部观察到,DR条件下的mtd mRNA表达量增加了7倍。如果能一直坚持DR,整个生命周期中的mtd表达均显著增加。也就是说,饮食限制能够增加果蝇神经元中mtd的表达。但与之相反,当采用组成型活性elav-Gal4驱动神经元mtd mRNA干扰后,无论是采用何种饮食模式,甚至DR,均会诱导果蝇发育缺陷的发生以及严重的寿命缩短。Mtd/OXR1中的TLDc结构域发挥着保护神经的作用。于是,研究者进一步在不携带mtd等位基因的果蝇神经元中过表达了缩减的人OXR1基因(hOXR1OE),观察到果蝇“找回了”丢失的寿命和DR反应。由此可见,神经元mtd的表达是DR介导的寿命延长过程中必不可少的一环,如果将其敲除则会诱发严重的发育缺陷以及寿命缩短。利用公开的ChIP-seq数据,研究者找到了DR中调节mtd表达的关键点——Traffic Jam(TJ)。具体来说,ChIP-seq数据显示基因座上存在CCCTC结合因子(CTCF)和TJ的重要结合信号。其中,诱导性神经元ctcfRNA干扰增加了mtd的表达,而tjRNA干扰则导致DR条件下所有mtd转录表达的降低以及寿命的缩短。事实上,饮食限制主要限制了整体蛋白质摄入量,进一步的验证显示,蛋白质限制诱导的mtd增加受到TJ的调控,从而延长了果蝇的寿命;但在正常饮食条件下,mtd表达则会受到CTCF的影响而被抑制。不过,这些效应只影响变异位点和TJ/CTCF结合位点下游的较短转录本。研究者解释道,体内营养相关成分的增加并非好事儿,反而可能会带来一定的健康损害,比如逆转录酶失调,甚至进一步缩短了寿命。在“向下”找到了影响mtd表达的关键因素之后,接下来“向上”探索mtd影响寿命的具体机制。这个过程究竟是如何实现的呢?研究者分析了与人OXR1共表达模式相似的前50个基因的基因本体(GO)术语,并对人成纤维细胞的OXR1和囊泡转运细胞器标记物进行了共同染色,包括溶酶体、核内体、高尔基体、内质网和线粒体。进一步的实验观察到,OXR1染色与内体标志物RAB7高度重叠。这时候,如果对神经元mtdRNA进行干扰,会发现果蝇体内Atg8a-II水平有所增加,即自噬体形成的标志物增加。研究者解释道,由于内吞蛋白和脂质的不当运输,内体中逆运复合体(retromer)功能障碍会导致溶酶体功能障碍,以及自噬体形成的增加。因此,可以推测,OXR1具有维持逆运复合体功能的作用。果不其然,当研究者对果蝇体内的神经元mtdRNA和tjRNA进行干扰时,逆运复合体蛋白水平被显著降低了,证明上述推测是正确的。事实上,对于健康的神经元来说,逆运复合体的维持是必不可少的;相反,当缺失逆运复合体蛋白时,则会诱导神经退行性疾病的发生。所以,mtd基因之所以能发挥抗衰和保护神经的作用,是因为它参与了逆运复合体功能的维持。最后一步,回归人体——mtd/OXR1表达是否能够发挥防止神经退行性疾病和阿尔茨海默症发生的作用呢?利用人类组学数据集,研究者观察到,在丰度水平与OXR1基因呈正相关的蛋白质和受年龄影响的基因中,有83个基因存在重叠。进一步对数据集重叠基因进行KEGG通路分析,结果显示,与年龄相关的神经退行性疾病(包括阿尔茨海默症、亨廷顿氏症、帕金森病等)均出现了显著的富集。此外,研究者观察到,低水平的OXR1、VPS35、SNX5和RAB7A与阿尔茨海默症的诊断、记忆力和病理评分低下有关,而这些都是人OXR1和逆运复合体相关蛋白。相反,如果过表达了OXR1或逆运复合体,则能够挽救与阿尔茨海默症以及tau病理相关的表型。正如先前提到的那样,逆运复合体功能障碍与年龄相关性退行性神经疾病(比如阿尔茨海默症)之间有着紧密联系,尤其是在疾病进展的转运和突触功能的维持。鉴于OXR1与逆运复合体之间的关系,OXR1及其蛋白网络是减缓人类和果蝇衰老和与年龄相关的神经退行性疾病的关键调节剂。综上所述,本研究发现了一个重要基因mtd/OXR1——在间歇性禁食或者卡路里限制等营养限制的策略中,mtd/OXR1基因水平会有所提高,进一步激活了逆运复合体功能,发挥出维持神经元功能、延缓大脑衰老以及寿命延长等多种作用,对大脑健康产生正向影响。本研究的共同通讯作者Kenneth Wilson还强调了另一个观点“饮食会影响人体内所有的过程”。所以,只要你努力坚持健康饮食方式,身体是不会“辜负”你的,而且这种影响会比你想象得更大。总结来说,吃得少,活得久,脑更灵。春节想必大家一定吃了不少吧,从今天开始可以加入“少吃”行列了哦参考资料:[1]Wilson, K.A., Bar, S., Dammer, E.B. et al. OXR1 maintains the retromer to delay brain aging under dietary restriction. Nat Commun 15, 467 (2024). https://doi.org/10.1038/s41467-023-44343-3撰文 | Swagpp编辑 | Swagpp文章来源:梅斯医学 -
 二甲双胍恐损害大脑认知功能,加剧阿尔茨海默症病理。 二甲双胍(Metformin)是治疗II型糖尿病的一线药物,可通过抑制肝脏葡萄糖的产生而发挥降糖作用。早在1957年,二甲双胍便被正式运用于临床治疗糖尿病;在我国也有着超30年的临床应用经验。全球范围内,约有1.5亿人在服用二甲双胍,可谓是目前应用最广泛的口服降糖药之一。当然,二甲双胍之所以能被“每月一夸”,是因为其远超降低血糖的效果。随着科学的不断推进,对二甲双胍的研究从未停止,现阶段发现的药物作用已超过20种,包括:保护心血管、减少超重/肥胖、改善血脂代谢、降低部分肿瘤风险等,以及改善阿尔茨海默症(AD)。先前,研究者观察到一个常见的现象——2型糖尿病患者罹患阿尔茨海默症的风险往往会增加,推测两种疾病具有共同的致病机制“胰岛素抵抗”。而作为一种强效的胰岛素增敏剂,二甲双胍能够通过激活AMP依赖的蛋白激酶(AMPK)对机体的新陈代谢产生益处,并发挥作用。基于此,二甲双胍成为治疗AD的“最具竞争力”候选药之一。但反转出现了!近日,Nature子刊上最新发表的研究却给了大家“当头一棒”——长期二甲双胍治疗可能会损害AD个体的大脑认知功能。更具体来说,“神药”二甲双胍的药效应该分情况讨论,对于年轻和老年以及AD个体会产生不同影响。在年轻小鼠中,长达1-2年的二甲双胍治疗能够提高它们的注意力、抑制控制和联想学习能力;然而,在年纪大一些的小鼠中,长期服用二甲双胍则会导致记忆保持力和辨别学习能力受损,尤其是本身患有AD的。研究者选择了两种小鼠来开展实验,包括非转基因小鼠C57BL/6(正常)和转基因小鼠3xTg-AD(罹患AD),并在它们的几乎整个生命周期内服用了二甲双胍。根据小鼠的每日饮水量(约5mL/天)计算得出二甲双胍的给药剂量为300mg/kg/天,换算为人类临床上使用的2000mg/人/天。在年轻的C57BL/6小鼠中,二甲双胍的“神药”地位并未被撼动。在服用二甲双胍的情况下,年轻小鼠的注意力、抑制控制和联想学习能力均得到了增强。具体来说,研究者采用五项选择连续反应时间任务(5-CSRT)测试了小鼠的注意力情况。结果显示,在二甲双胍治疗下,年轻小鼠表现出更高的反应准确性、更低的过早反应以及对正确刺激更高的持久性反应。也就是说,二甲双胍增强了年轻C57BL/6小鼠与额叶相关的执行功能。与此同时,研究者还采用目标定位配对联想学习(PAL)任务评估了小鼠脑颞叶相关的学习和记忆,发现:在准确性和纠正试验中存在明显的药物与时间交互作用,说明二甲双胍提高了小鼠的学习表现能力。不过,上述“改善作用”仅存在于12-14个月大的中年小鼠中,而非17个月大的大龄小鼠中。然而,反转出现了!在超过19个月大的老年C57BL/6小鼠中,长期二甲双胍治疗却带来了一定的健康弊端——老年小鼠的视觉分辨和记忆保持能力受到了损害。视觉分辨和反转学习测试显示,二甲双胍治疗后的25月龄小鼠的视觉分辨能力出现了障碍,但反转学习能力相当(说明认知灵活性方面没有差异)。同时,当研究者采用保持记忆测试小鼠后发现,与对照组相比,服用二甲双胍的表现出记忆保持障碍。而在本身就患有阿尔茨海默症的个体中,长期二甲双胍治疗更是加剧了AD小鼠的认知能力下降。众所周知,“神药”二甲双胍具有延长寿命的作用,而这一趋势确实体现在3xTg-AD小鼠身上。但是PAL测试显示,长期二甲双胍治疗导致AD小鼠的关联性学习障碍,加剧了认知能力的下降。进一步的探究找到了这把打开“潘多拉魔盒”的钥匙——AD小鼠中海马AMPKα1-亚基的上调。正如文首提及的那样,AMPK功能紊乱以及AMPK亚基表达改变会诱发AD病理;而服用二甲双胍后,小鼠海马中AMPKα1的表达明显增加,进而诱导了认知障碍的发生。与此同时,长期二甲双胍治疗还会增加Aβ寡聚体以及Aβ斑块的水平,明显增加Ser356和Thr231处的p-tau水平。这些发现都证明,二甲双胍的长期治疗会加剧AD病理。综上所述,二甲双胍不适用于治疗阿尔茨海默症,长期服用甚至会导致AD小鼠的学习障碍以及加重AD病理。不过,也不必一棒子打死,二甲双胍的适用情况需要分类讨论——在年轻小鼠中,二甲双胍的治疗确实增强了认知;但在老年和AD小鼠中,长时间的服用却诱导认知障碍和加剧AD病理。当然,上述研究还停留在动物实验层面,需要进一步的人类试验去进一步证明。但这一发现也给临床用药带来了警示,在AD患者中使用二甲双胍需要尤其小心!还是那句话,“药无完药”,连“神药”二甲双胍也有翻车的时候......参考资料:[1]Cho SY, Kim EW, Park SJ, Phillips BU, Jeong J, Kim H, Heath CJ, Kim D, Jang Y, López-Cruz L, Saksida LM, Bussey TJ, Lee DY, Kim E. Reconsidering repurposing: long-term metformin treatment impairs cognition in Alzheimer's model mice. Transl Psychiatry. 2024 Jan 18;14(1):34. doi: 10.1038/s41398-024-02755-9. PMID: 38238285; PMCID: PMC10796941.撰文|Swagpp排版|Swagpp文章来源:梅斯医学
二甲双胍恐损害大脑认知功能,加剧阿尔茨海默症病理。 二甲双胍(Metformin)是治疗II型糖尿病的一线药物,可通过抑制肝脏葡萄糖的产生而发挥降糖作用。早在1957年,二甲双胍便被正式运用于临床治疗糖尿病;在我国也有着超30年的临床应用经验。全球范围内,约有1.5亿人在服用二甲双胍,可谓是目前应用最广泛的口服降糖药之一。当然,二甲双胍之所以能被“每月一夸”,是因为其远超降低血糖的效果。随着科学的不断推进,对二甲双胍的研究从未停止,现阶段发现的药物作用已超过20种,包括:保护心血管、减少超重/肥胖、改善血脂代谢、降低部分肿瘤风险等,以及改善阿尔茨海默症(AD)。先前,研究者观察到一个常见的现象——2型糖尿病患者罹患阿尔茨海默症的风险往往会增加,推测两种疾病具有共同的致病机制“胰岛素抵抗”。而作为一种强效的胰岛素增敏剂,二甲双胍能够通过激活AMP依赖的蛋白激酶(AMPK)对机体的新陈代谢产生益处,并发挥作用。基于此,二甲双胍成为治疗AD的“最具竞争力”候选药之一。但反转出现了!近日,Nature子刊上最新发表的研究却给了大家“当头一棒”——长期二甲双胍治疗可能会损害AD个体的大脑认知功能。更具体来说,“神药”二甲双胍的药效应该分情况讨论,对于年轻和老年以及AD个体会产生不同影响。在年轻小鼠中,长达1-2年的二甲双胍治疗能够提高它们的注意力、抑制控制和联想学习能力;然而,在年纪大一些的小鼠中,长期服用二甲双胍则会导致记忆保持力和辨别学习能力受损,尤其是本身患有AD的。研究者选择了两种小鼠来开展实验,包括非转基因小鼠C57BL/6(正常)和转基因小鼠3xTg-AD(罹患AD),并在它们的几乎整个生命周期内服用了二甲双胍。根据小鼠的每日饮水量(约5mL/天)计算得出二甲双胍的给药剂量为300mg/kg/天,换算为人类临床上使用的2000mg/人/天。在年轻的C57BL/6小鼠中,二甲双胍的“神药”地位并未被撼动。在服用二甲双胍的情况下,年轻小鼠的注意力、抑制控制和联想学习能力均得到了增强。具体来说,研究者采用五项选择连续反应时间任务(5-CSRT)测试了小鼠的注意力情况。结果显示,在二甲双胍治疗下,年轻小鼠表现出更高的反应准确性、更低的过早反应以及对正确刺激更高的持久性反应。也就是说,二甲双胍增强了年轻C57BL/6小鼠与额叶相关的执行功能。与此同时,研究者还采用目标定位配对联想学习(PAL)任务评估了小鼠脑颞叶相关的学习和记忆,发现:在准确性和纠正试验中存在明显的药物与时间交互作用,说明二甲双胍提高了小鼠的学习表现能力。不过,上述“改善作用”仅存在于12-14个月大的中年小鼠中,而非17个月大的大龄小鼠中。然而,反转出现了!在超过19个月大的老年C57BL/6小鼠中,长期二甲双胍治疗却带来了一定的健康弊端——老年小鼠的视觉分辨和记忆保持能力受到了损害。视觉分辨和反转学习测试显示,二甲双胍治疗后的25月龄小鼠的视觉分辨能力出现了障碍,但反转学习能力相当(说明认知灵活性方面没有差异)。同时,当研究者采用保持记忆测试小鼠后发现,与对照组相比,服用二甲双胍的表现出记忆保持障碍。而在本身就患有阿尔茨海默症的个体中,长期二甲双胍治疗更是加剧了AD小鼠的认知能力下降。众所周知,“神药”二甲双胍具有延长寿命的作用,而这一趋势确实体现在3xTg-AD小鼠身上。但是PAL测试显示,长期二甲双胍治疗导致AD小鼠的关联性学习障碍,加剧了认知能力的下降。进一步的探究找到了这把打开“潘多拉魔盒”的钥匙——AD小鼠中海马AMPKα1-亚基的上调。正如文首提及的那样,AMPK功能紊乱以及AMPK亚基表达改变会诱发AD病理;而服用二甲双胍后,小鼠海马中AMPKα1的表达明显增加,进而诱导了认知障碍的发生。与此同时,长期二甲双胍治疗还会增加Aβ寡聚体以及Aβ斑块的水平,明显增加Ser356和Thr231处的p-tau水平。这些发现都证明,二甲双胍的长期治疗会加剧AD病理。综上所述,二甲双胍不适用于治疗阿尔茨海默症,长期服用甚至会导致AD小鼠的学习障碍以及加重AD病理。不过,也不必一棒子打死,二甲双胍的适用情况需要分类讨论——在年轻小鼠中,二甲双胍的治疗确实增强了认知;但在老年和AD小鼠中,长时间的服用却诱导认知障碍和加剧AD病理。当然,上述研究还停留在动物实验层面,需要进一步的人类试验去进一步证明。但这一发现也给临床用药带来了警示,在AD患者中使用二甲双胍需要尤其小心!还是那句话,“药无完药”,连“神药”二甲双胍也有翻车的时候......参考资料:[1]Cho SY, Kim EW, Park SJ, Phillips BU, Jeong J, Kim H, Heath CJ, Kim D, Jang Y, López-Cruz L, Saksida LM, Bussey TJ, Lee DY, Kim E. Reconsidering repurposing: long-term metformin treatment impairs cognition in Alzheimer's model mice. Transl Psychiatry. 2024 Jan 18;14(1):34. doi: 10.1038/s41398-024-02755-9. PMID: 38238285; PMCID: PMC10796941.撰文|Swagpp排版|Swagpp文章来源:梅斯医学 -
 科学家们确定了禁食如何预防炎症 炎症是人体免疫系统的一种潜在破坏性副作用,是许多慢性疾病的基础。研究人员发现了一种新的方法,确定了禁食是如何帮助减少炎症的。剑桥大学1月30日消息剑桥大学(University of Cambridge)的科学家们发表在《细胞报告》(Cell Reports)上的研究中,研究人员描述了禁食如何提高血液中一种名为花生四烯酸(Arachidonic acid)的化学物质的水平,这种化学物质可以抑制炎症。研究人员表示,这也有助于解释阿司匹林等药物的一些有益作用。研究于2024年1月23日发表在《Cell Reports》(最新影响因子:8.8)杂志上科学家们早就知道,我们的饮食,尤其是高热量的西方饮食,会增加我们患疾病的风险,包括肥胖、2型糖尿病和心脏病,这些都与体内的慢性炎症有关。炎症是我们身体对损伤或感染的自然反应,但这一过程可以由其他机制触发,包括所谓的“炎性小体”(Inflammasome),它在我们身体细胞内起着警报的作用,当我们的身体感受到损伤时,触发炎症来保护我们的身体。但炎性小体也可以以无意的方式触发炎症,其功能之一是摧毁不需要的细胞,这会导致细胞内容物释放到体内,从而引发炎症。剑桥大学医学系的 Clare Bryant 教授说:“我们非常有兴趣尝试了解许多人类疾病中慢性炎症的原因,尤其是炎性小体的作用。”“近年来变得明显的是,一个炎性小体( NLRP3 炎性小体)在许多重大疾病中非常重要,例如肥胖症和动脉粥样硬化,还有像阿尔茨海默病和帕金森病这样的疾病,这些疾病在老年人中很常见,特别是在西方国家。”禁食有助于减少炎症,但原因尚不清楚。为了帮助回答这个问题,由 Bryant 教授和她在剑桥大学和美国国立卫生研究院(NIH)的同事领导的一个团队研究了 21 名志愿者的血液样本,他们先吃了一顿 500 千卡的饭,然后禁食 24 小时,再吃第二顿 500 千卡的饭。研究小组发现,限制卡路里摄入会增加一种被称为花生四烯酸的脂质水平。脂质是在我们的身体中发挥重要作用的分子,例如储存能量和在细胞之间传递信息。一旦人们再次进食,花生四烯酸的水平就会下降。当研究人员在实验室中研究花生四烯酸对免疫细胞的作用时,他们发现花生四烯酸可以降低 NLRP3 炎性小体的活性。这让研究小组感到惊讶,因为此前花生四烯酸被认为与炎症水平的增加有关,而不是降低。剑桥大学皇后学院的 Bryant 教授补充说:“这为改变我们的饮食(尤其是禁食)如何保护我们免受炎症(尤其是导致许多与西方高热量饮食有关的疾病的破坏性疾病)提供了一个潜在的解释。”由于花生四烯酸的作用只是短暂的,所以说禁食是否能预防阿尔茨海默病和帕金森病还为时过早,但我们的工作为越来越多的科学文献提供了证据,表明限制卡路里对健康有益。研究表明,长期规律禁食有助于减少与这些疾病相关的慢性炎症。这无疑是一个有吸引力的想法。”研究结果还暗示了高热量饮食可能增加这些疾病风险的一种机制。研究表明,一些高脂饮食的患者炎性小体活性水平增加。“这里可能存在一种阴阳效应,即过多或过少都会增加或减少炎性小体的活性,” Bryant 教授说,“花生四烯酸可能是实现这一效果的一种方式。”研究人员表示,这一发现也可能为阿司匹林等所谓的非甾体抗炎药以一种意想不到的方式发挥作用提供线索。通常情况下,花生四烯酸在体内会迅速分解,但阿司匹林会阻止这一过程,这可能会导致花生四烯酸水平增加,降低炎性小体活性,从而导致炎症。Bryant 教授说:“需要强调的是,在没有医疗指导的情况下,不应该为了降低长期疾病的风险而服用阿司匹林,因为长期服用会产生副作用,比如胃出血。”参考文献Source:University of CambridgeScientists identify how fasting may protect against inflammationReference:Pereira, M & Liang, J et al. Arachidonic acid inhibition of the NLRP3 inflammasome is a mechanism to explain the anti-inflammatory effects of fasting. Cell Reports; 23 Jan 2024; DOI: 10.1016/j.celrep.2024.113700文章来源:阿尔茨海默病
科学家们确定了禁食如何预防炎症 炎症是人体免疫系统的一种潜在破坏性副作用,是许多慢性疾病的基础。研究人员发现了一种新的方法,确定了禁食是如何帮助减少炎症的。剑桥大学1月30日消息剑桥大学(University of Cambridge)的科学家们发表在《细胞报告》(Cell Reports)上的研究中,研究人员描述了禁食如何提高血液中一种名为花生四烯酸(Arachidonic acid)的化学物质的水平,这种化学物质可以抑制炎症。研究人员表示,这也有助于解释阿司匹林等药物的一些有益作用。研究于2024年1月23日发表在《Cell Reports》(最新影响因子:8.8)杂志上科学家们早就知道,我们的饮食,尤其是高热量的西方饮食,会增加我们患疾病的风险,包括肥胖、2型糖尿病和心脏病,这些都与体内的慢性炎症有关。炎症是我们身体对损伤或感染的自然反应,但这一过程可以由其他机制触发,包括所谓的“炎性小体”(Inflammasome),它在我们身体细胞内起着警报的作用,当我们的身体感受到损伤时,触发炎症来保护我们的身体。但炎性小体也可以以无意的方式触发炎症,其功能之一是摧毁不需要的细胞,这会导致细胞内容物释放到体内,从而引发炎症。剑桥大学医学系的 Clare Bryant 教授说:“我们非常有兴趣尝试了解许多人类疾病中慢性炎症的原因,尤其是炎性小体的作用。”“近年来变得明显的是,一个炎性小体( NLRP3 炎性小体)在许多重大疾病中非常重要,例如肥胖症和动脉粥样硬化,还有像阿尔茨海默病和帕金森病这样的疾病,这些疾病在老年人中很常见,特别是在西方国家。”禁食有助于减少炎症,但原因尚不清楚。为了帮助回答这个问题,由 Bryant 教授和她在剑桥大学和美国国立卫生研究院(NIH)的同事领导的一个团队研究了 21 名志愿者的血液样本,他们先吃了一顿 500 千卡的饭,然后禁食 24 小时,再吃第二顿 500 千卡的饭。研究小组发现,限制卡路里摄入会增加一种被称为花生四烯酸的脂质水平。脂质是在我们的身体中发挥重要作用的分子,例如储存能量和在细胞之间传递信息。一旦人们再次进食,花生四烯酸的水平就会下降。当研究人员在实验室中研究花生四烯酸对免疫细胞的作用时,他们发现花生四烯酸可以降低 NLRP3 炎性小体的活性。这让研究小组感到惊讶,因为此前花生四烯酸被认为与炎症水平的增加有关,而不是降低。剑桥大学皇后学院的 Bryant 教授补充说:“这为改变我们的饮食(尤其是禁食)如何保护我们免受炎症(尤其是导致许多与西方高热量饮食有关的疾病的破坏性疾病)提供了一个潜在的解释。”由于花生四烯酸的作用只是短暂的,所以说禁食是否能预防阿尔茨海默病和帕金森病还为时过早,但我们的工作为越来越多的科学文献提供了证据,表明限制卡路里对健康有益。研究表明,长期规律禁食有助于减少与这些疾病相关的慢性炎症。这无疑是一个有吸引力的想法。”研究结果还暗示了高热量饮食可能增加这些疾病风险的一种机制。研究表明,一些高脂饮食的患者炎性小体活性水平增加。“这里可能存在一种阴阳效应,即过多或过少都会增加或减少炎性小体的活性,” Bryant 教授说,“花生四烯酸可能是实现这一效果的一种方式。”研究人员表示,这一发现也可能为阿司匹林等所谓的非甾体抗炎药以一种意想不到的方式发挥作用提供线索。通常情况下,花生四烯酸在体内会迅速分解,但阿司匹林会阻止这一过程,这可能会导致花生四烯酸水平增加,降低炎性小体活性,从而导致炎症。Bryant 教授说:“需要强调的是,在没有医疗指导的情况下,不应该为了降低长期疾病的风险而服用阿司匹林,因为长期服用会产生副作用,比如胃出血。”参考文献Source:University of CambridgeScientists identify how fasting may protect against inflammationReference:Pereira, M & Liang, J et al. Arachidonic acid inhibition of the NLRP3 inflammasome is a mechanism to explain the anti-inflammatory effects of fasting. Cell Reports; 23 Jan 2024; DOI: 10.1016/j.celrep.2024.113700文章来源:阿尔茨海默病 -
 阿尔茨海默氏症治疗的重大突破 全球医疗保健公司Insightec宣布,使用聚焦超声(FUS)技术治疗阿尔茨海默病的突破性临床研究已在《新英格兰医学杂志》上发表。该研究与西弗吉尼亚大学洛克菲勒神经科学研究所 (RNI) 合作进行,提出了一种新的治疗方法,将聚焦超声打开血脑屏障与全身单克隆抗体输注相结合。该方法显著增强了大脑β-淀粉样蛋白的去除,这是阿尔茨海默病的关键指标,显示出针对神经系统疾病的靶向药物递送的潜力。Insightec 首席执行官 Maurice R. Ferré 医学博士强调了跨血脑屏障给药的挑战,并强调了这一进步的重要性。RNI 的医学博士 Ali Rezai 对研究结果以及与 Insightec 的持续合作表示乐观。这一突破为治疗全球3500万阿尔茨海默病人提供了新的希望,标志着在解决这一关键医疗的需求方面迈出了重大一步。在全球约5500 万痴呆症患者中,估计60% 至70% 是因为患有阿尔茨海默病。文章来源: 腾讯网
阿尔茨海默氏症治疗的重大突破 全球医疗保健公司Insightec宣布,使用聚焦超声(FUS)技术治疗阿尔茨海默病的突破性临床研究已在《新英格兰医学杂志》上发表。该研究与西弗吉尼亚大学洛克菲勒神经科学研究所 (RNI) 合作进行,提出了一种新的治疗方法,将聚焦超声打开血脑屏障与全身单克隆抗体输注相结合。该方法显著增强了大脑β-淀粉样蛋白的去除,这是阿尔茨海默病的关键指标,显示出针对神经系统疾病的靶向药物递送的潜力。Insightec 首席执行官 Maurice R. Ferré 医学博士强调了跨血脑屏障给药的挑战,并强调了这一进步的重要性。RNI 的医学博士 Ali Rezai 对研究结果以及与 Insightec 的持续合作表示乐观。这一突破为治疗全球3500万阿尔茨海默病人提供了新的希望,标志着在解决这一关键医疗的需求方面迈出了重大一步。在全球约5500 万痴呆症患者中,估计60% 至70% 是因为患有阿尔茨海默病。文章来源: 腾讯网 -
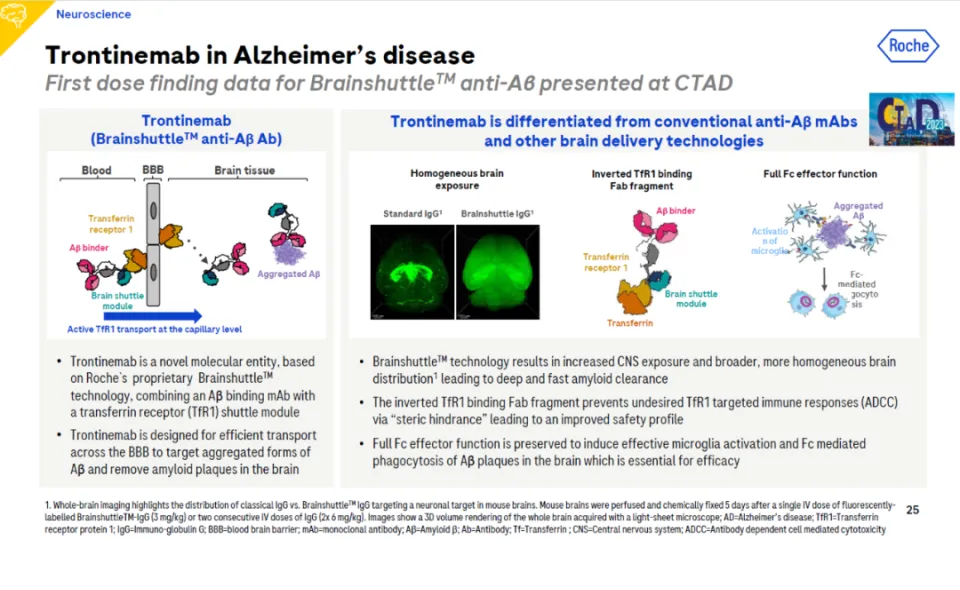
 阿尔茨海默病治疗再获突破,穿越血脑屏障新方法登上NEJM 腾讯网阿尔茨海默病(AD)的治疗近年来突破连连,美国FDA已经批准两款靶向β淀粉样蛋白的单克隆抗体上市。近日,中国国家药监局(NMPA)也批准了卫材(Eisai)递交的1类新药仑卡奈单抗(lecanemab)注射液的上市申请,用于治疗确认淀粉样蛋白病理的AD相关轻度认知功能障碍(MCI)和轻度AD痴呆。抗淀粉样蛋白单抗的作用机制是通过与大脑中的β淀粉样蛋白结合,清除大脑中淀粉样蛋白的沉积。然而抗淀粉样蛋白抗体分子量较大,药物向脑组织递送的过程中受到血脑屏障的阻碍。如何穿越血脑屏障,是治疗阿尔茨海默病,以及多种中枢神经系统疾病需要解决的挑战之一。日前在著名医学期刊《新英格兰医学杂志》(NEJM)上的一项最新研究显示,利用低强度聚焦超声波能够可逆性地开放AD患者的血脑屏障,并且加快患者大脑中淀粉样蛋白的清除速度。在这项研究中,研究人员对三名确诊患有AD相关轻度认知功能障碍的患者进行了抗淀粉样蛋白抗体阿杜卡努单抗(aducanumab)的治疗,这款单抗已经获得美国FDA的加速批准,用于治疗阿尔茨海默病,但是它穿透血脑屏障的能力有限,导致患者需要长期治疗才能显著降低大脑中的淀粉样蛋白水平。聚焦超声波可以通过产生机械波,对血管壁施加机械应力,导致内皮细胞之间的紧密连接拉伸和打开。这会暂时破坏血脑屏障的完整性,让治疗分子能够扩散进入大脑,血脑屏障大约在几个小时内会自动愈合。此前,研究人员已经发现,利用聚焦超声波可以帮助递送抗体药物进入脑转移瘤。在这项研究中,三位受试者在接受阿杜卡努单抗治疗的同时,使用聚焦超声波对大脑的一个半球进行治疗,接受治疗6个月后,研究人员对受试者大脑淀粉样蛋白沉积的水平进行了检测。结果发现,在所有三名参与者中,接受聚焦超声波治疗脑区的淀粉样蛋白沉积清除程度均大于作为对照的另一半大脑。接受治疗26周后,淀粉样蛋白水平的指标平均比对照脑区降低32%。研究人员同时对三名参与者的认知能力进行了评估,三名参与者中的两位在随后的随访中并未发现任何认知能力、行为或神经病理学的变化。第三位参与者在随访期第30天进行的检测中发现认知能力评分RBANS的分数下降,不过没有发现神经病理变化和日常生活能力评分的变化。研究人员表示,在这项概念验证临床试验中,将聚焦超声波与阿杜卡努单抗联用,能够安全地加速β淀粉样蛋白水平的降低。这与以前临床前研究显示超声波可以提高阿杜卡努单抗穿越血脑屏障的结果一致。聚焦超声波以外,业界也在尝试穿越血脑屏障的其它技术。其中进展较快的技术是利用转铁蛋白受体(TfR)。在治疗阿尔茨海默病方面,罗氏的trontinemab是一款运用罗氏大脑穿梭(brain shuttle)技术的靶向淀粉样蛋白单克隆抗体。它将靶向淀粉样蛋白的单克隆抗体与可以和转铁蛋白受体相结合的蛋白域融合,可以有效协助抗体穿越血脑屏障。去年年末公布的初步临床试验结果显示,与罗氏之前所开发的淀粉样蛋白靶向抗体gantenerumab相较,trontinemab在患者体内脑脊液/血浆比率比前者高8倍,并且更快速地降低大脑的淀粉样蛋白水平。Trontinemab简介(图片来源:罗氏官网)Denali Therapeutics基于TfR的递送系统在治疗II型黏多糖贮积症的临床试验中也获得积极结果。该公司还与渤健达成研发协议,利用这一递送系统增强抗淀粉样蛋白抗体的效力。血脑屏障是保护大脑免受有害物质侵害的重要屏障,但也同时是阻止治疗药物向大脑递送的重要障碍。这在治疗阿尔茨海默病,帕金森病等一系列神经退行性疾病方面尤为突出。期待穿越血脑屏障的技术在临床试验中得到进一步的验证,助力未来为阿尔茨海默病和其它中枢神经系统疾病患者提供更好的新治疗选择。文章来源:腾讯网
阿尔茨海默病治疗再获突破,穿越血脑屏障新方法登上NEJM 腾讯网阿尔茨海默病(AD)的治疗近年来突破连连,美国FDA已经批准两款靶向β淀粉样蛋白的单克隆抗体上市。近日,中国国家药监局(NMPA)也批准了卫材(Eisai)递交的1类新药仑卡奈单抗(lecanemab)注射液的上市申请,用于治疗确认淀粉样蛋白病理的AD相关轻度认知功能障碍(MCI)和轻度AD痴呆。抗淀粉样蛋白单抗的作用机制是通过与大脑中的β淀粉样蛋白结合,清除大脑中淀粉样蛋白的沉积。然而抗淀粉样蛋白抗体分子量较大,药物向脑组织递送的过程中受到血脑屏障的阻碍。如何穿越血脑屏障,是治疗阿尔茨海默病,以及多种中枢神经系统疾病需要解决的挑战之一。日前在著名医学期刊《新英格兰医学杂志》(NEJM)上的一项最新研究显示,利用低强度聚焦超声波能够可逆性地开放AD患者的血脑屏障,并且加快患者大脑中淀粉样蛋白的清除速度。在这项研究中,研究人员对三名确诊患有AD相关轻度认知功能障碍的患者进行了抗淀粉样蛋白抗体阿杜卡努单抗(aducanumab)的治疗,这款单抗已经获得美国FDA的加速批准,用于治疗阿尔茨海默病,但是它穿透血脑屏障的能力有限,导致患者需要长期治疗才能显著降低大脑中的淀粉样蛋白水平。聚焦超声波可以通过产生机械波,对血管壁施加机械应力,导致内皮细胞之间的紧密连接拉伸和打开。这会暂时破坏血脑屏障的完整性,让治疗分子能够扩散进入大脑,血脑屏障大约在几个小时内会自动愈合。此前,研究人员已经发现,利用聚焦超声波可以帮助递送抗体药物进入脑转移瘤。在这项研究中,三位受试者在接受阿杜卡努单抗治疗的同时,使用聚焦超声波对大脑的一个半球进行治疗,接受治疗6个月后,研究人员对受试者大脑淀粉样蛋白沉积的水平进行了检测。结果发现,在所有三名参与者中,接受聚焦超声波治疗脑区的淀粉样蛋白沉积清除程度均大于作为对照的另一半大脑。接受治疗26周后,淀粉样蛋白水平的指标平均比对照脑区降低32%。研究人员同时对三名参与者的认知能力进行了评估,三名参与者中的两位在随后的随访中并未发现任何认知能力、行为或神经病理学的变化。第三位参与者在随访期第30天进行的检测中发现认知能力评分RBANS的分数下降,不过没有发现神经病理变化和日常生活能力评分的变化。研究人员表示,在这项概念验证临床试验中,将聚焦超声波与阿杜卡努单抗联用,能够安全地加速β淀粉样蛋白水平的降低。这与以前临床前研究显示超声波可以提高阿杜卡努单抗穿越血脑屏障的结果一致。聚焦超声波以外,业界也在尝试穿越血脑屏障的其它技术。其中进展较快的技术是利用转铁蛋白受体(TfR)。在治疗阿尔茨海默病方面,罗氏的trontinemab是一款运用罗氏大脑穿梭(brain shuttle)技术的靶向淀粉样蛋白单克隆抗体。它将靶向淀粉样蛋白的单克隆抗体与可以和转铁蛋白受体相结合的蛋白域融合,可以有效协助抗体穿越血脑屏障。去年年末公布的初步临床试验结果显示,与罗氏之前所开发的淀粉样蛋白靶向抗体gantenerumab相较,trontinemab在患者体内脑脊液/血浆比率比前者高8倍,并且更快速地降低大脑的淀粉样蛋白水平。Trontinemab简介(图片来源:罗氏官网)Denali Therapeutics基于TfR的递送系统在治疗II型黏多糖贮积症的临床试验中也获得积极结果。该公司还与渤健达成研发协议,利用这一递送系统增强抗淀粉样蛋白抗体的效力。血脑屏障是保护大脑免受有害物质侵害的重要屏障,但也同时是阻止治疗药物向大脑递送的重要障碍。这在治疗阿尔茨海默病,帕金森病等一系列神经退行性疾病方面尤为突出。期待穿越血脑屏障的技术在临床试验中得到进一步的验证,助力未来为阿尔茨海默病和其它中枢神经系统疾病患者提供更好的新治疗选择。文章来源:腾讯网